同济大学程黎明/朱融融/高绍荣揭示FBXL12调控小胶质细胞促进脊髓损伤无瘢痕修复的功能及机制研究,成果发表于《信号转导与靶向治疗》
来源:生命科学与技术学院
时间:2025-08-27 浏览:
近日,同济大学附属同济医院程黎明教授、同济大学生命科学与技术学院高绍荣教授、朱融融教授在《信号转导与靶向治疗》(Signal Transduction and Targeted Therapy)杂志在线发表题为“F-box/LRR-repeat protein 12 reorchestrated microglia to inhibit scarring and achieve adult spinal cord injury repair”的研究论文。该研究利用RNA-seq、LC-MS-based mRNA修饰分析及表观转录组芯片对脊髓损伤病理进程进行了长时程多组学联合解析,首次揭示了脊髓病理进程的关键调控因子Fbxl12,并阐明了其作为脊髓损伤后无瘢痕修复新靶点的分子作用机制,进而围绕Fbxl12建立了全新脊髓损伤无瘢痕修复干预策略。

脊髓损伤(SCI)后组织内部的瘢痕是阻碍神经环路重塑的关键屏障,使得现有的皮质神经元治疗靶点(如PTEN基因沉默和超白细胞介素-6)及干细胞移植等组织工程学手段无法实现完美的修复效果,而抑制瘢痕组织形成的关键在于对脊髓损伤病理进程的深入解析以及对瘢痕形成关键细胞的命运调控。在该研究中,研究人员通过对SCI后不同病理时期小鼠脊髓进行表观遗传组学芯片测序,初步描绘了脊髓损伤后的mRNA甲基化图谱,结合转录本测序进行多组学联合分析发现Fbxl12是N6-甲基腺苷(m6A)参与脊髓损伤病理进程的核心修饰靶点,并明确小胶质细胞是Fbxl12发挥功能的关键细胞。
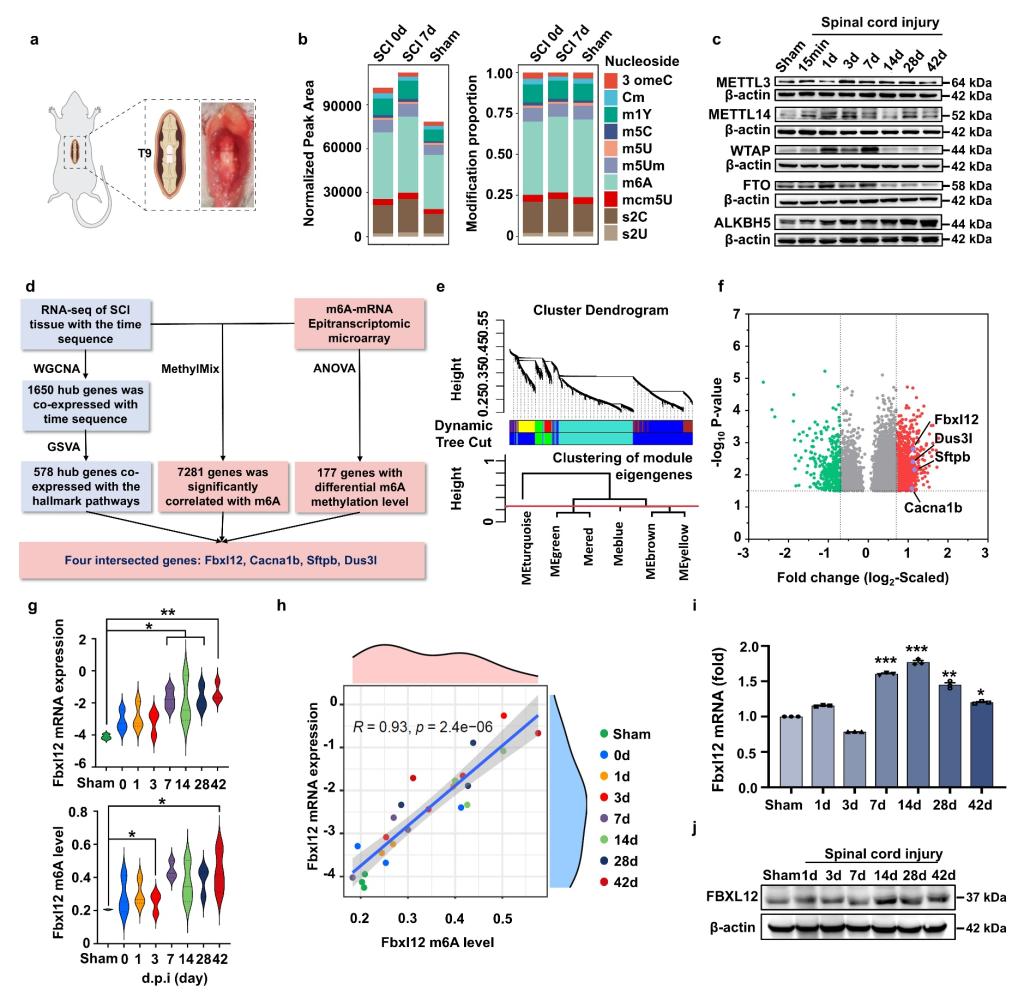
图1. Fbxl12 mRNA的m6A甲基化是脊髓损伤病理进程中的关键调控过程
研究者发现在损伤激活的小胶质细胞中m6A可促进FBXL12的合成。随后通过建立Fbxl12基因编辑的小胶质细胞系及原代提取的小胶质细胞,发现Fbxl12调控小胶质细胞骨架重排,进而增强其迁移能力。通过细胞水平RNA-seq和细胞多因子检测发现,Fbxl12过表达可促使小胶质细胞呈现"无瘢痕愈合"表型,即促炎趋化因子和促纤维化细胞因子分泌下调,稳态相关细胞因子分泌上调。
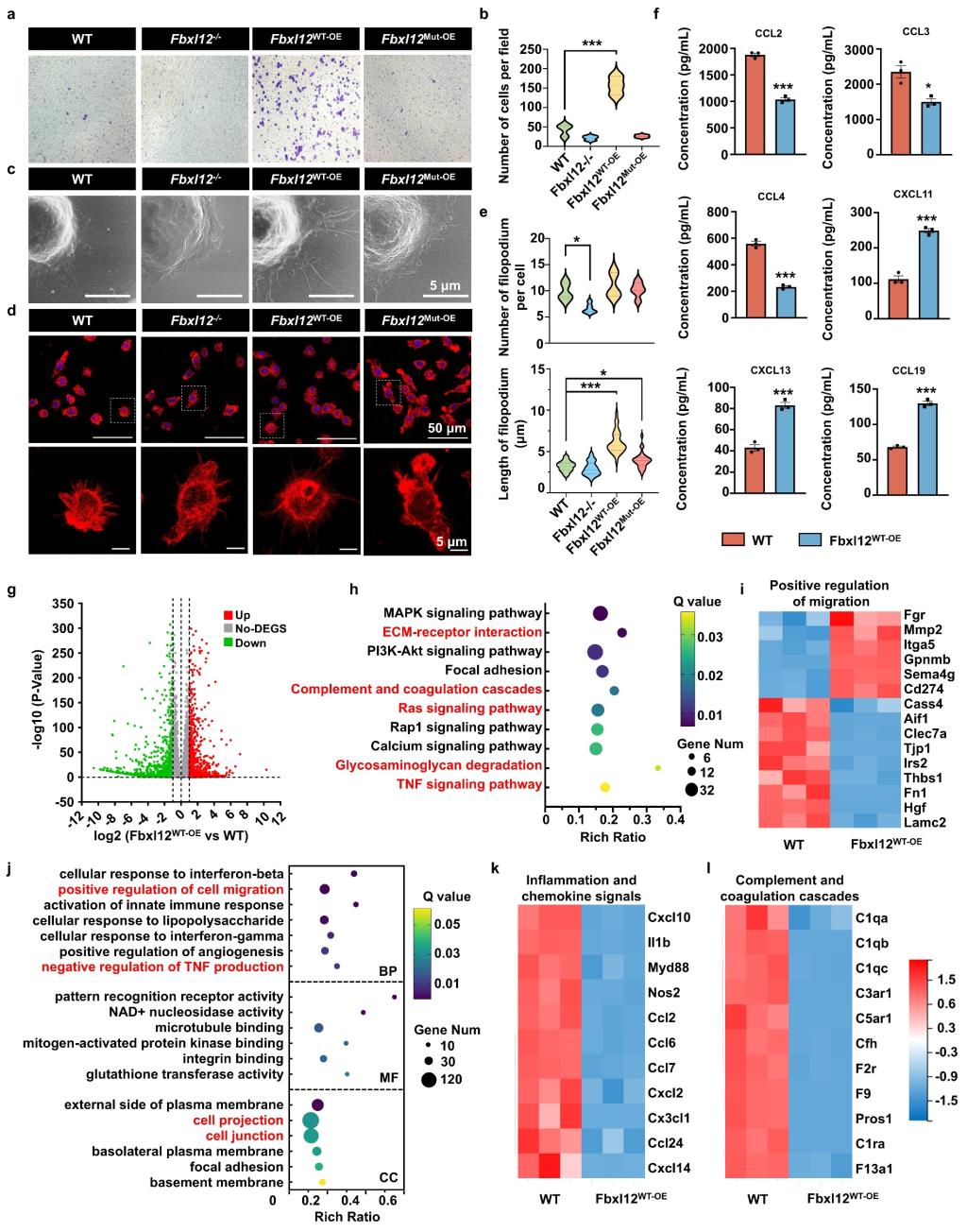
图2. Fbxl12调控小胶质细胞迁移及免疫功能
在脊髓损伤后第7天以AAV为载体靶向过表达小胶质细胞中FBXL12可促进其向损伤中心的快速迁移,改善免疫微环境,诱导神经干细胞向损伤位点迁移。更重要的是,小胶质细胞中FBXL12的过表达使损伤位点细胞外基质沉积减少,显著减小胶质瘢痕和纤维瘢痕的面积并降低瘢痕密度约70%。在SCI后56天,治疗组小鼠脊髓中皮质脊髓束及5-羟色胺能神经元显著再生,轴突成功穿越损伤中心区并持续向下生长,延伸长度超2.4毫米,重建了小鼠脊髓神经回路,显著改善小鼠电生理及运动功能。
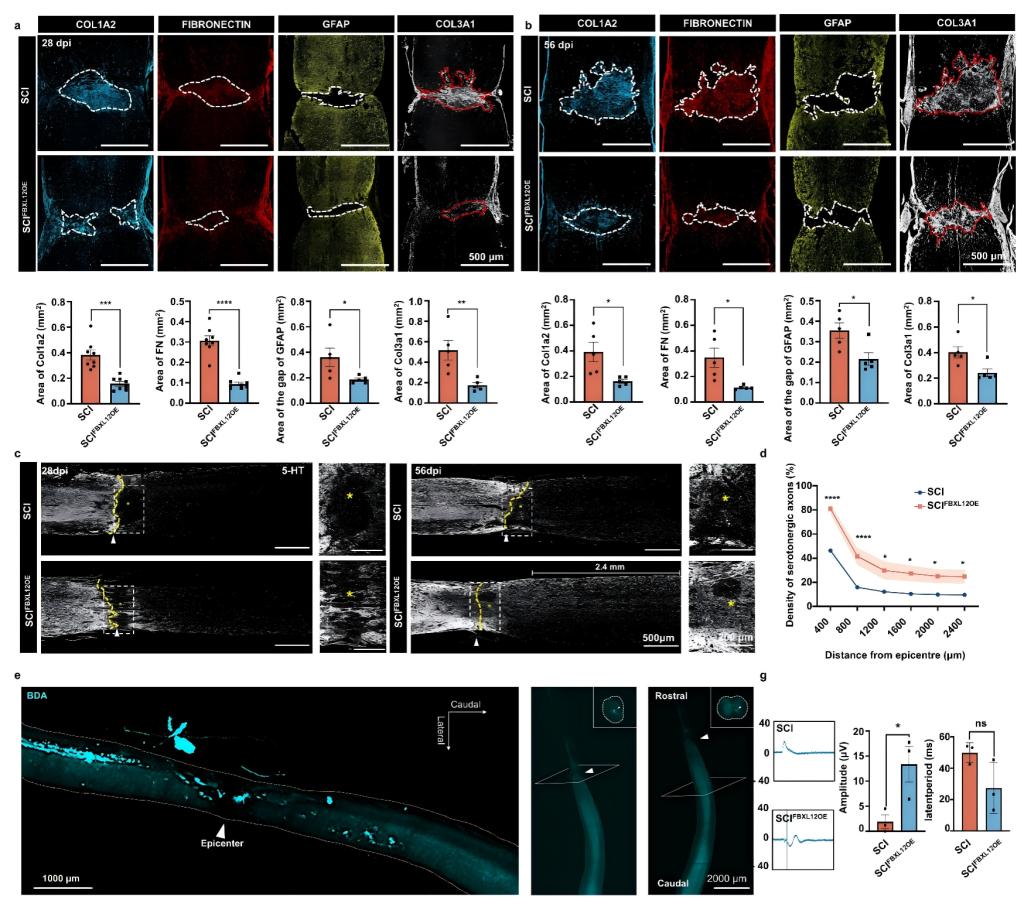
图3. 靶向过表达小胶质细胞Fbxl12抑制脊髓损伤后瘢痕形成促进神经再生
进一步的机制研究表明,FBXL12通过K63泛素化修饰以稳定小胶质细胞中肌球蛋白重链14(MYH14),增加细胞丝状伪足数量,延长丝状伪足长度,促进小胶质细胞骨架重组和迁移。
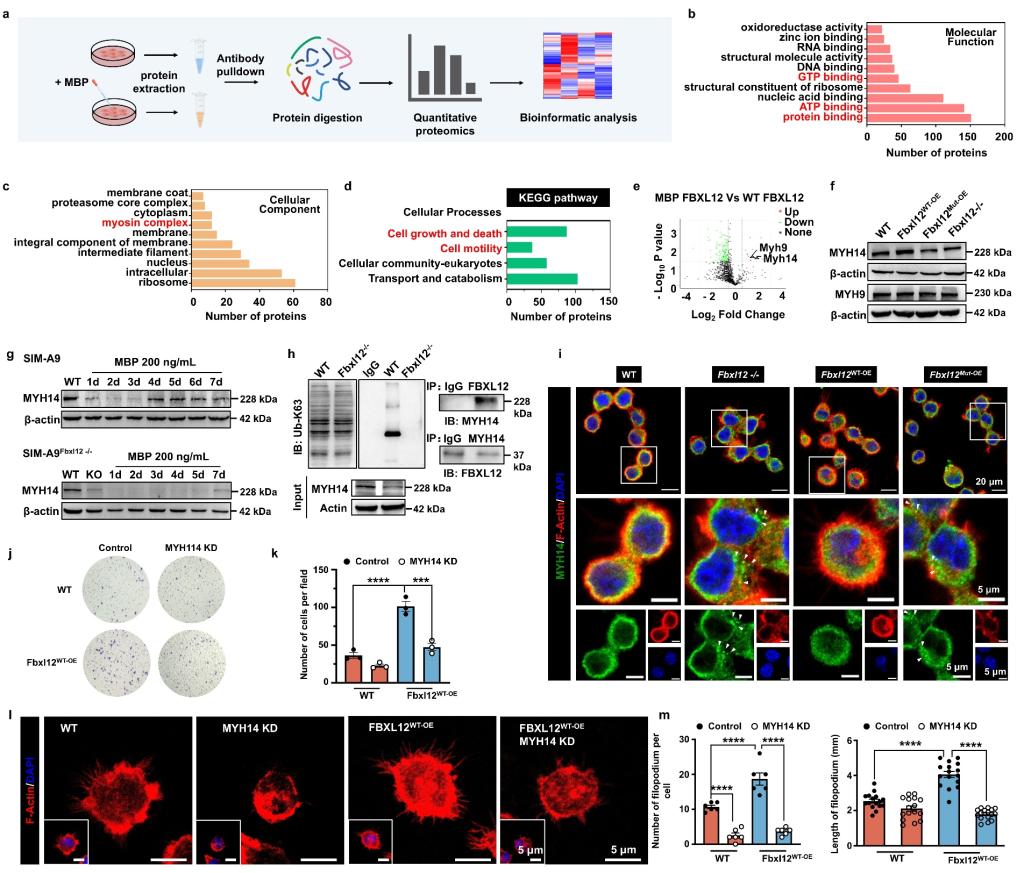
图4. FBXL12通过促进MYH14的K63泛素化调控小胶质细胞骨架重组
该研究首次揭示m6A-FBXL12-MYH14轴构成激活的小胶质细胞新型骨架重组通路,证实FBXL12可作为基于小胶质细胞的新型治疗靶点,实现脊髓损伤的无瘢痕功能修复。基于研究者在无瘢痕愈合和微环境改善方面的发现,未来联合神经营养因子或其他临床治疗手段,有望最大化脊髓损伤后的功能恢复效果——这一策略在人类患者中具有潜在应用价值。
同济大学附属同济医院程黎明教授、同济大学生命科学与技术学院高绍荣教授和朱融融教授为论文共同通讯作者。同济大学徐徐、高枫、陈琦昕、陈柏如为共同第一作者。该研究获得了科技部国家重点研发计划、国家杰出青年科学基金、国家自然科学基金委重点项目以及中央高校基本科研业务费项目的大力支持。
论文链接:https://www.nature.com/articles/s41392-025-02354-0