同济大学史偈君/李新星团队揭示直肠癌新辅助放化疗应答的作用机制,成果发表于《前沿科学》
来源:生命科学与技术学院
时间:2025-11-07 浏览:
结直肠癌在我国的发病率与死亡率均在所有癌症中居前列,特别是直肠癌近年来呈年轻化趋势。尽管免疫检查点抑制剂在微卫星不稳定型(MSI-H/dMMR)直肠癌中效果显著,但对占多数的微卫星稳定型(MSS)患者疗效有限。目前,新辅助放化疗仍是MSS型直肠癌的标准治疗方案,但患者反应差异显著,其机制尚不明确。
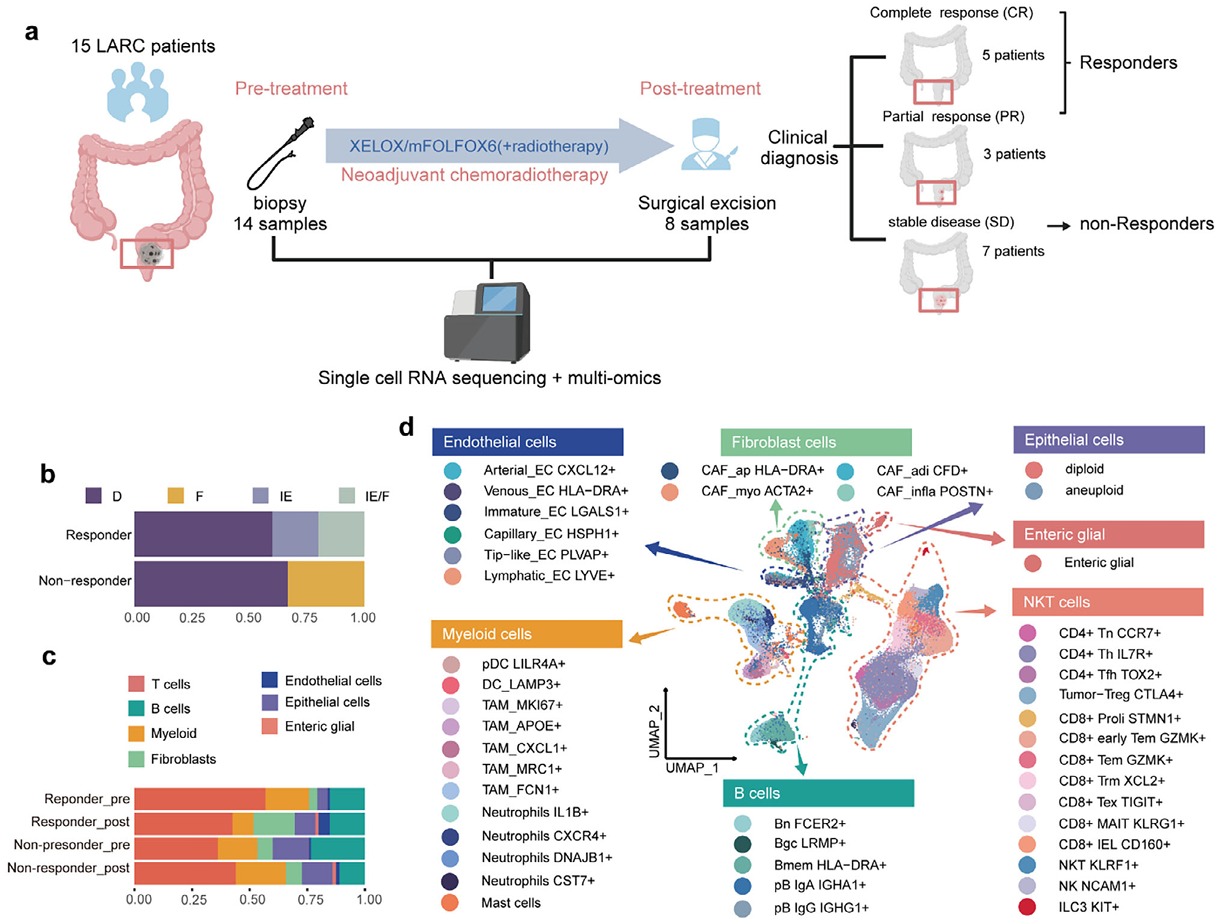
近日,同济大学生命科学与技术学院史偈君团队,联合附属同济医院普外科李新星团队,在国际期刊《前沿科学》(Advanced Science)上发表了题为“T Cell Exhaustion and Dendritic Cell-Mediated Tertiary Lymphoid Structures(TLSs)Modulation Affect Response to Neoadjuvant Chemoradiotherapy in Microsatellite Stable Rectal Cancer”的研究论文。通过多组学与单细胞测序技术,系统揭示了MSS型局部晚期直肠癌患者肿瘤微环境中早期耗竭T细胞(early-Tex)与三级淋巴结构(TLS)在调控新辅助放化疗疗效中的关键作用,为MSS型直肠癌的治疗提供了新思路。

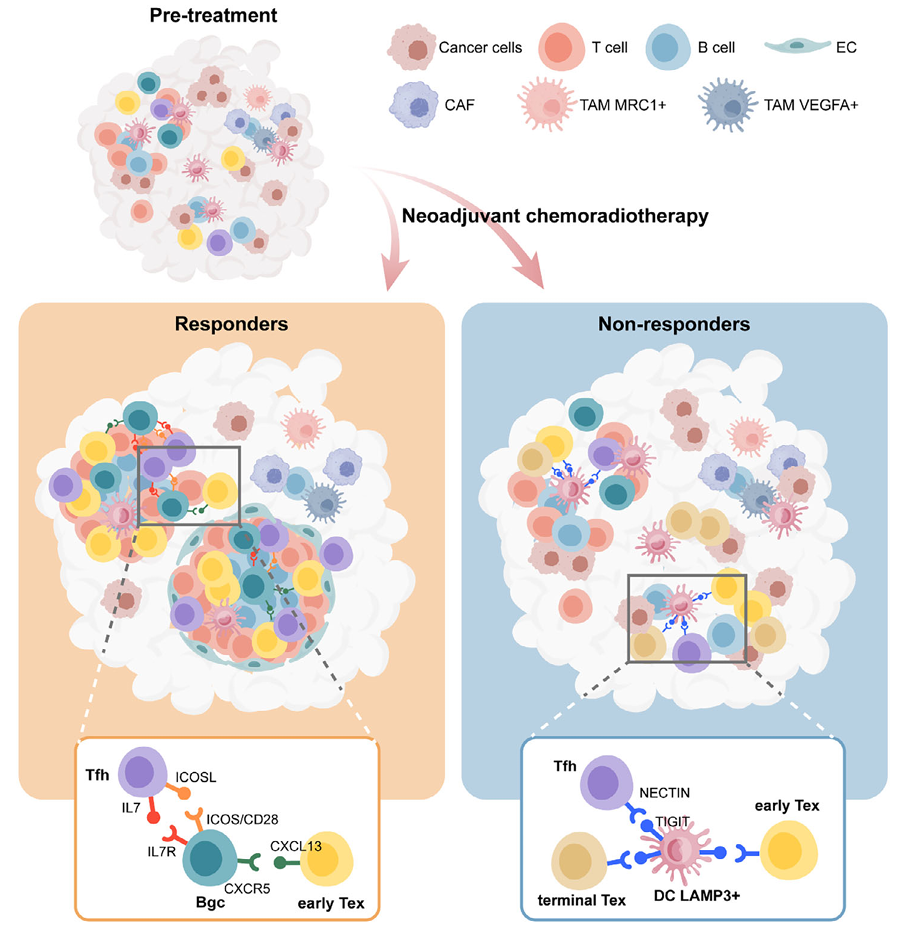
该研究通过对15例接受新辅助放化疗的患者进行单细胞RNA测序、全外显子测序和转录组测序,发现响应者与非响应者之间的基因突变谱无显著差异,而肿瘤微环境的免疫特征与治疗响应密切相关;鉴定出一类具有增殖能力和效应功能的早期耗竭T细胞亚群(early-Tex),与疗效高度关联,其高表达转录因子NR1D2,并在响应者中显著富集,该细胞亚群与经典前体耗竭T细胞(Tpex)在分子表型和功能上均有差异;响应者肿瘤组织中TLS数量更多、更成熟、更活跃,TLS的形成与Tfh细胞、B细胞和高内皮静脉(HEV)密切相关,并在空间转录组数据中得到验证;LAMP3+DCs通过表达IRF8等转录因子,增强其免疫抑制功能,并通过PD-1/PD-L1、TIGIT等共抑制分子通路促进T细胞耗竭,从而抑制TLS的形成,影响治疗效果。
同济大学史偈君研究员,附属同济医院李新星副主任医师、黄琦主任医师为论文共同通讯作者;同济大学王淼、余乐毅,附属同济医院徐楷、印小毛为论文共同第一作者;附属同济医院胡志前主任医师等为研究提供了有力支持。该研究工作得到国家自然科学基金、上海市科委等项目的支持。
论文链接:https://advanced.onlinelibrary.wiley.com/doi/full/10.1002/advs.202514332